Los estados de agregación de la materia son una forma de definir el comportamiento de las moléculas que forman una sustancia o un compuesto. Todo el Universo está formado por materia y esta puede encontrarse en tres estados de agregación diferentes: sólido, líquido o gaseoso.
Los estados de agregación de la materia también se conocen como estados físicos y las propiedades de cada uno dependen de las uniones que se establecen entre las diferentes moléculas que conforman la materia.
Además de la fuerza de unión entre las moléculas también entra en juego el continuo movimiento de dichas moléculas que no son visibles a simple vista. El movimiento depende de la temperatura y aumenta proporcionalmente, es decir, cuanta mayor temperatura existe mayor movimiento se produce.
Los estados de agregación de la materia son tres: sólido, líquido y gas
Esto que os acabamos de explicar se corresponde con la teoría cinética y gracias a esta teoría pueden explicarse fácilmente por qué una misma sustancia puede encontrarse en diferentes estados de agregación. En definitiva, depende de cómo se agrupan y se ordenan las partículas de la sustancia.

En física, se ha estudiado mucho el comportamiento de cualquier sustancia cuando se enfrenta a diferentes condiciones de temperatura y presión.
Estado sólido
El estado sólido es uno de los más observables. Las propiedades de los sólidos son: masa constante, volumen constante y forma constante. En este caso, las partículas que lo constituyen tienen una gran cohesión y por ello son capaces de adoptar formas bien definidas. Las moléculas se encuentran ordenadas y perfectamente juntas.
Estado líquido
Las propiedades de los líquidos son: masa constante, volumen constante y forma variable. Se trata de un estado de agregación de la materia en el que tenemos un fluido incomprensible, es decir, mantiene su volumen hasta un rango bastante elevado de presión. Las moléculas del líquido se mantienen unidas entre sí mediante enlaces intermoleculares.
Por ejemplo, en el caso del agua, las moléculas se encuentran unidas mediante puentes de hidrógeno y por ello ésta tiene tanta tensión superficial. Las partículas de líquido tienden a adoptar la forma del recipiente que los contiene, pero no se expanden ni se dispersan para llenar cada espacio del contenedor. Los líquidos suelen tener una densidad constante.
Estado gaseoso
El estado gaseoso puede resultarnos el más peculiar de todos. Las moléculas gaseosas no crean enlaces entre sí por lo que estas tienden a separarse y expandirse. A diferencia de los líquidos, los gases son fluidos altamente comprensibles, que además sufren grandes cambios de densidad cuando las condiciones de temperatura y presión cambian.
Los gases adoptan la forma y el volumen del recipiente que las contiene, por ello se dice que las propiedades de los gases son: masa constante, volumen y forma variables. Las moléculas que componen un gas se mueven de forma constante y desordenada por lo que chocan entre ellas y contra las paredes del recipiente que lo contiene.
El volumen que ocupa un gas varía con la temperatura (si mantenemos la presión constante), de tal forma que el volumen aumenta con la temperatura y vicecersa, el volumen disminuye si lo hace la temperatura. También ocurre que a temperatura constante, cuando aumentamos la presión del gas disminuye su volumen y al revés.
Los cambios de estado
Un cambio de estado consiste en pasar de un estado de agregación de la materia a otro en una misma sustancia o compuesto, y el cambio se produce porque ha habido una modificación de la temperatura o de la presión. Cada elemento o compuesto químico necesita diferentes condiciones de presión y temperatura para cambiar de estado físico.
De hecho, como seguramente ya habrás observado, cada elemento de la tabla periódica tiene un estado predeterminado que es el que suele presentarse a temperatura ambiente. Si tenemos en cuenta una presión constante, por ejemplo, la presión atmosférica a nivel del mar (1 atm), sabemos que en función de la temperatura una sustancia puede encontrarse en estado líquido, sólido o gaseoso.
Los procesos mediante los cuales una sustancia cambia de estado reciben nombres diferentes en función del estado de agregación de la materia del que partimos y hacia el que vamos. De este modo hablamos de:
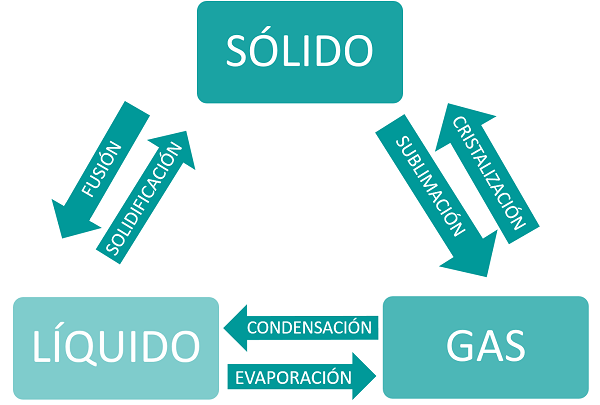
Evaporación
Cuando pasamos de líquido a gas. Aquí entran en juego dos términos más, la vaporización y la ebullición. Son términos que se refieren a lo mismo, pero con matices. Hablaremos de vaporización cuando la evaporación tenga lugar sólo en la superficie del líquido y de ebullición cuando todo el líquido se encuentre en su punto de ebullición lo que querrá decir que todo el líquido se encuentra a la misma temperatura y está cambiando de estado.
Sublimación
La sublimación tiene lugar cuando pasamos de sólido a gas directamente sin una fase líquida intermedia.
Condensación
La condensación es el cambio de estado de gas a líquido, la temperatura a la que tiene lugar es el punto de ebullición.
Cristalización o sublimación inversa
La cristalización se podría definir como un proceso de sublimación inversa, es decir, el cambio de estado gaseoso a estado sólido.
Solidificación
Es el cambio de estado líquido a estado sólido mediante el enfriamiento de la sustancia, es decir, quitamos temperatura y el líquido se va solidificando. El punto de congelación o de solidificación es la temperatura a la que el líquido comienza a solidificar, y suele coincidir con el de fusión si hablamos de la misma sustancia.
Fusión
Cuando pasamos de sólido a líquido. La temperatura a la que tiene lugar el cambio de una sustancia de sólido a líquido se denomina temperatura de fusión o punto de fusión. El punto de fusión es diferente para cada sustancia.
Aquí ocurre algo curioso y es que mientras haya parte de sólido que aún no se ha convertido en líquido la temperatura no cambiará, se mantendrá constante en el punto de fusión. Esto ocurre porque la energía se invierte en romper las uniones intermoleculares que siguen quedando y no en darles más velocidad, que es lo que hace que aumente la temperatura.
Tanto el punto de ebullición como el de fusión son propiedades específicas de cada sustancia en particular. A continuación te dejamos con algunos ejemplos de los puntos de fusión y de ebullición de algunas sustancias comunes:
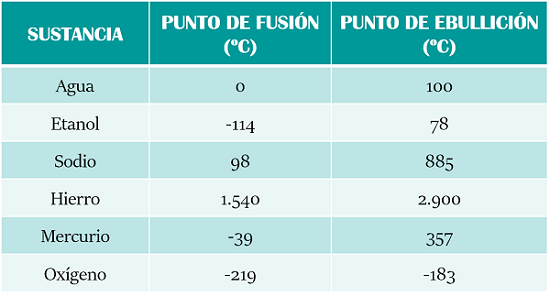
De la tabla anterior podemos deducir, por ejemplo, que el agua está líquida a temperatura ambiente y que se convierte en hielo (estado sólido) cuando baja de los 0 ºC y que por otra parte, para obtener vapor de agua necesitamos que esta suba a más de 100ºC. Algo que puede parecer muy obvio en el caso del agua, resulta mucho más curioso con el resto de elementos.
Por ejemplo, el oxígeno es un gas a temperatura ambiente que puede tornarse líquido a partir de los -183ºC pero que no se solidificará hasta los -219ºC. Por su parte, el mercurio se encuentra en estado líquido a temperatura ambiente y no se convierte en sólido hasta los -39ºC. Para conseguir vapor de mercurio necesitaríamos llegar hasta los 357ºC.
Y hasta aquí la explicación de cuáles son los estados de agregación de la materia. Esperamos haberte ayudado a comprender mejor todo lo que comprende un cambio físico. Si tienes alguna duda, estaremos en los comentarios.


